Ондулин из чего сделан: Из чего сделан состав ондулина, аналог
Содержание
Из чего сделан состав ондулина, аналог
Содержание статьи:
1. Краткая характеристика ондулина
2. Преимущества монтажа кровли из ондулина
3. Особенности состава ондулина, технологии его производства
4. Основные компоненты, входящие в состав ондулина
5. Где может использоваться ондулин
Большинство людей, даже не сведущих ничего в строительстве, имеют общее представление об ондулине: для одних он является стройматериалом, для других – кровельным покрытием. Однако знаниями о его характеристиках и уникальных свойствах порой не могут похвастаться даже специалисты. Итак, чем же привлекателен этот материал для застройщиков?
Краткая характеристика ондулина
Ондулин является современным материалом, используемым для укладки кровли, который сочетает в себе такие свойства как легкость и прочность одновременно. При производственной гарантии в 15 лет он отлично эксплуатируется порядка 50 лет. Листы ондулина изготавливаются без добавления асбеста, который входит в состав обычного шифера и негативно воздействует на здоровье людей.
Листы ондулина изготавливаются без добавления асбеста, который входит в состав обычного шифера и негативно воздействует на здоровье людей.
Помимо этого, застройщики, не имеющие представление о том, из чего делают ондулин, поражаются его возможностям выдерживать любые климатические условия, например, при использовании в регионах, где сильная жара или, наоборот, суровые морозы.
Большое значение имеет правильность устройства обрешетки, поскольку такая конструкция наделяет кровельное покрытие дополнительными свойствами – оно хорошо справляется со снеговой нагрузкой, а также с ураганным ветром скоростью в 53 м/с. Все приведенные выше данные подтверждены учеными Америки и Великобритании.
Преимущества монтажа кровли из ондулина
Среди неоспоримых преимуществ материала выделяют:
- Способность низкого водопоглощения, благодаря чему в подкровельном пространстве всегда сохраняется нужный микроклимат, а листы в случае снижения температуры до 0 градусов остаются в прежнем виде.

- Наличие хорошей устойчивости к погодным изменениям в виде дождя, снега, ветра и других климатических воздействий.
- Препятствие к образованию грибка и бактерий.
- Наличие защитных свойств от воздействия кислот, щелочей, промышленных газов и других химических реакций.
- Использование в производстве безвредных компонентов. В ондулин состав входит экологически чистое сырье, поэтому на выходе получается безопасная для окружающих существ продукция.
По мере развития строительства кровель из ондулина, ему дали второе название – еврошифер, хотя отличие одного от другого выявляется сразу же. Ондулин легко разрезается, не ломается во время забивания гвоздей, предлагается в разных цветовых вариантах, что можно увидеть на фото, внешне очень элегантный и современный. Если клиент решил сам выбрать, чем покрасить ондулин, то он может сделать индивидуальный заказ (подробнее: «Как и чем покрасить ондулин – и вообще, можно ли его красить»).
При долгой эксплуатации (7-10 лет) покрытие может утратить свою яркость и привлекательность, тогда его достаточно покрасить в нужный цвет. Однако перед нанесением акриловой, виниловой или эпокси-виниловой краски, проводится подготовка поверхности – грунтовка покрытия.
Для установки кровли может использоваться также и любой аналог ондулина, например прозрачный ондулин, который также называют прозрачным шифером. Монтаж и ремонт ондулина, а также его материалов-аналогов, в целом, осуществляется так же, как и работа с шифером, отличие возможно только в характеристиках исходных материалов и их состава.
Ондулин изготавливается из профилированных отходов картонажного производства, прошедших дополнительную обработку битумом. За несколько лет своего существования в строительной отрасли он прошел путь реконструкционного полотна для готовых кровель до самодостаточного кровельного материала. Цветовая гамма ондулина представлена коричневым, красным, зеленым и черным цветами (прочтите подробнее: «Какой цвет ондулина выбрать»).
Особенности состава ондулина, технологии его производства
Для многих застройщиков немаловажен вопрос ондулин из чего сделан, и какими свойствами обладают еще составляющие. В производстве кровельного материала используется макулатура, битум и большое количество минеральных компонентов. На предварительном этапе все перечисленное проходит тщательную проверку на соответствие качественных требований.
В ходе первого «мокрого» этапа макулатура очищается от мусора и преобразуется в бумажную массу, которая и станет основой будущего покрытия. Второй этап заключается в обработке полученной пульпы – ее опускают на конвейер, где под действием машин ей придают волнистую форму и тщательно просушивают.
Сухие заготовки разрезаются на листы нужной длины и в специальном цехе пропитываются составом битума и формируются паллетами, которые учитывают размер листа ондулина.
После окрашивания материал снова пропитывается слоем битума – наличие данного этапа делает технологию изготовления ондулина уникальной, не похожей на изготовление его аналогов. Верхний слой битума служит защитой от выцветания краски.
Верхний слой битума служит защитой от выцветания краски.
На завершающем этапе листы ондулина упаковываются, сверху на них наматываются пленки ондулин для предотвращения механического повреждения при транспортировке.
За 4 секунды конвейер обрабатывает 1 лист, а все этапы материал проходит примерно за 45 минут.
Основные компоненты, входящие в состав ондулина
При детальном рассмотрении компонентов, из чего состоит ондулин, можно представить следующий перечень:
- обработанное целлюлозное волокно;
- глубоко очищенный битум;
- минеральный наполнитель;
- смолы.
Что касается технических параметров, то:
- длина ондулина 2 м;
- ширина листа 0,95 м;
- полная толщина около 3 мм;
- высота волн – 36 мм.

За счет небольшого веса (всего 6,5 кг) данное кровельное покрытие легко транспортируется и монтируется.
Особые физико-механические свойства в целом создают высококачественный материал, не имеющий аналогов на рынке:
- Уровень разрушения ондулиновой кровли равен 960 кгс/кв. м., притом, что разрушению подвергается не сам лист, а его основа (обрешетка для ондулина).
- При максимальной термической стойкости материал полностью сохраняет свои качества и форму.
- При изменении температуры окружающей среды наблюдается лишь незначительное изменение теплопроводности покрытия, например, при скачках отметки термометра с 35 градусов на 40 градусов и, затем, на 50 градусов она составит 0.19 Ккал/мчoС, 0.20 Ккал/мчoС и 0.195 Ккал/мчoС соответственно.
- Звукоизоляция равна 40 Дб.
- Внешний вид и структура материала не меняется даже при 25 циклах заморозки и оттаивания.

Где может использоваться ондулин
Ондулин используется при монтаже кровли частных домов и коттеджей. Легкий материал может укладываться прямо поверх старого покрытия. Поскольку нагрузка создается минимальная, то можно не беспокоиться о дополнительном укреплении стропильной системы. Такая технология позволяет выполнять работу без вскрытия крыши, тем самым защищая внутренние помещения от атмосферного воздействия.
Привлекательность внешнего вида, удобство укладки, гибкость материала – вот лишь небольшой перечень преимуществ данного кровельного покрытия, в дополнение к которому может быть добавлена покраска ондулина в любой цвет. Все это позволяет использовать материал не только в строительстве жилых зданий, но и объектов торговли, кафе, развлекательных клубов и других зданий подобного назначения. Отметим, что все коммерческие сборные сооружения могут быть с легкой ондулиновой кровлей.
Высокий уровень пластичности листов покрытия успешно используется в строительстве.Любая криволинейная плоскость с радиусом кривизны более 5 м может быть покрыта данным материалом.
Для тех, кто при укладке кровли отдает предпочтение черепице, предлагается ондулин мягкая черепица, получаемая с помощью особой технологии монтажа материала, внешне достаточно похожая на черепичное покрытие.
Как положить ондулин на старую кровлю, инструкция на видео:
Чтобы добиться такого результата, ондулин распиливается на несколько полосок длиной по 50 см и крепится к обрешетке, сделанной с шагом 30 см.
Существует и другой способ использования ондулина – ондутайл, при котором материал служит подложкой для черепицы. За счет дополнительного слоя увеличивается качество кровли.
Кровельное покрытие успешно справляется и не только с первостепенными задачами, но и служит в качестве облицовочного материала или ограждения.
Перечень технических характеристик ондулина, экологичность и качество компонентов, входящих в состав ондулина, возможности использования в разных сферах строительства – все это служит своего рода гарантией надежности представленного материала. Для большинства застройщиков, имеющих опыт работы с разными кровельными покрытиями, ондулин является уникальным (читайте: «Ондулин — строительные материалы: разновидность и особенности»).
Из чего сделан ондулин: какой материал, состав, выбор
Опубликовано:
27.09.2013
Комплект носков, Носки Omsa
349 ₽
Подробнее
Комплект носков, Носки Omsa
349 ₽
Подробнее
Недорогие межкомнатные двери
При выборе кровельного покрытия сегодня многие стараются найти привлекательный и прочный материал, который бы отличался невысокой ценой и легко мог быть уложен своими руками. Для того чтобы монтировать металлические листы, надо иметь определенные навыки, а вот такой материал, как ондулин, может быть уложен даже новичком. Кроме прочности, вторым вопросом, который волнует каждого владельца дома, является такой: горит ли ондулин и насколько он выдерживает непогоду.
Для того чтобы монтировать металлические листы, надо иметь определенные навыки, а вот такой материал, как ондулин, может быть уложен даже новичком. Кроме прочности, вторым вопросом, который волнует каждого владельца дома, является такой: горит ли ондулин и насколько он выдерживает непогоду.
Характеристика ондулина.
Все эти вопросы тесно связаны с технологией производства, особенностями состава кровельного покрытия. Выясним, из чего же создается ондулин, какими плюсами и минусами он отличается, как правильно его выбрать.
Что добавляют в состав ондулина?
Состав слоя онудулина.
Из чего же делают этот кровельный материал и что придает ему характерные свойства? Основным материалом, из которого изготавливают листы для покрытия кровли, является обычная целлюлозная масса. Конечно, это не бумага, к которой мы привыкли, целлюлозная масса перед формовкой проходит несколько стадий очистки и подготовки и только после этого подается в специальные машины для прессовки.
Кроме целлюлозы, в состав добавляется битум, прошедший предварительную глубокую очистку, отвердевающие смолы, наполнители и пигменты. Все материалы для производства ондулина экологически чистые, что выгодно отличается его от прочих в подобной ценовой нише. Например, любимый многими дачниками шифер производится из асбеста, который очень вреден и токсичен, при работе с ним необходимо не только надевать перчатки, но и защитную маску. Сделать кровлю из ондулина проще, чем из шифера, благодаря его легкости.
Вернуться к оглавлению
Из чего производят ондулин и каким образом?
Сам процесс производства представляет собой следующее:
- из целлюлозы получают пульпу, которая и станет основой листа в будущем;
- после этого в нее добавляются пигменты и наполнители, масса отправляется в специальный сушильный аппарат, где ей придается характерная волнистая форма;
- на последнем этапе лист под высокими температурами и давлением пропитывается при помощи битума, после чего высушивается и штабелируется.

Сами листы ондулина не поражают своей гаммой расцветок, но придать кровле привлекательность (особенно если укладывать материал двух оттенков в шахматном порядке) все же возможно. Среди предлагаемых цветов имеются:
- черный;
- коричневый;
- красный;
- зеленый.
Вернуться к оглавлению
Плюсы и минусы ондулина
Вопрос, из чего производят ондулин, напрямую влияет на свойства кровельного материала. Для начала рассмотрим преимущества использования ондулина, которые и делают его столь популярным вот уже столько десятилетий:
- Гидрофобность.
- Устойчивость к различным атмосферным явлениям.
- Устойчивость к образованию плесени, грибка, бактерий. Такой материал можно считать самым экологичным и безопасным для человека.
- Химическая устойчивость к негативному воздействию большей части кислот и щелочей.
- Ондулин не повреждается при попадании на его поверхность бензина и прочих продуктов нефтехимии.

- Гигиеничность. Чистить крышу очень легко, просто поливая ее из шланга.
- Малый вес, не оказывающий воздействия на конструкции дома.
- Низкая стоимость, что часто выступает решающим аргументом при покупке кровельного материала.
По ондулину нельзя ходить, так как могут остаться повреждения.
А теперь добавим «ложку дегтя», расскажем о недостатках ондулина, которые могут стать причиной отказа от его использования:
- Ондулин быстро и легко выцветает на солнце. Это не значит, что он полностью потеряет свой глубокий оттенок, но через пару лет вас может ждать неприятный сюрприз – поблекшая крыша.
- Производители дают гарантию только на то, что в течение срока годности листы не будут пропускать воду. Такие «мелкие», с их точки зрения, неприятности, как потеря цвета, несовпадение оттенка листов из различных упаковок, не являются гарантийными, замену производить никто не будет;
- Одним из минусов является и то, что пятна битума на поверхности листа не являются браком.
 Если при покупке вы не заметили их сразу, заменить упаковку будет трудно.
Если при покупке вы не заметили их сразу, заменить упаковку будет трудно. - По ондулину нельзя ходить, так как остается большая вмятина. Таким же свойством обладают и другие кровельные материалы, типа профилированных листов. Осторожность надо соблюдать и при транспортировке, подъеме листов на крышу;
- После намокания ондулин не держит форму! Обрешетка под ним должна быть идеально ровной;
- Ондулин – один из самых дешевых и простых по внешнему виду материалов. Производится он из вторичной целлюлозы, то есть макулатуры, что также сказывается на его цене.
Вернуться к оглавлению
Дополнительные элементы
Для укладки ондулина на кровлю необходимо приобрести следующее:
Рекомендации по монтажу ондулина.
- Специальные гвозди с цветными шляпками, выполненные из углеродистой стали, устойчивые и герметичные. В упаковке 100 штук, диаметр – 3,55 мм, цвет шляпки подбирается под цвет листа (на один лист уходит примерно 20 гвоздей).
- Конек для ребра крыши.
 Его длина – 100 см, полезная – 85 см.
Его длина – 100 см, полезная – 85 см. - Щипец для ската и фронтона. Длина – 110 см, полезная – 95 см.
- Материал для вентиляционной трубы из сополимера.
- Ендова. Длина – 100 см, полезная – 85 см.
- Заполнитель карниза для просвета между обрешеткой и листом. Может быть вентилируемым, невентилируемым. Производится из вспененного полиэтилена. Длина – 85 см, толщина – 2,5 см.
- Изоляционные ленты из бутилкаучука, алюминия. Ширина – 28 см, длина – 250 см.
- Закрывающий фартук из полипропилена. Длина – 940 мм, в упаковке по 25 штук.
Вернуться к оглавлению
Правила выбора ондулина
Обрешетка под ондулин.
Как мы могли убедиться, сделан ондулин очень качественно, но как правильно выбрать его на рынке? Сегодня этот материал производится во многих странах, но не все производители гарантируют отличное качество, что сказывается на сроках службы, эксплуатации, да и в целом на отношении к этому кровельному материалу. У некоторых он лежит по 15 лет, только немного выцветая под палящими лучами солнца, а у других начинает крошиться уже через пару лет после монтажа.
Так как выбрать ондулин, который сделан по всем правилам? Предлагаем вам несколько полезных советов от наших специалистов:
- Обратите внимание сначала на внешний вид листа. Оригинальный ондулин должен иметь десять волн, ширину листа в 950 мм, длину в 2000 мм, толщину в 3 мм, а вес его должен составлять 3-3,5 кг. Некачественные аналоги имеют меньшую толщину, каждый лист имеет не десять, а девять волн.
- На упаковке обязательно должно быть указано, что материал предназначен именно для покрытия кровли. Сегодня многие недобросовестные производители завозят более дешевую подкровельную изоляцию, которая схожа с ондулином, затем выдают ее за листы для покрытия крыши.
- Обращайте внимание на то, какой именно тип ондулина вы покупаете. Сегодня выпускается классический волнообразный шифер и черепица, которая крепится немного сложнее, но имеет более привлекательный внешний вид.
- Спрашивайте, какой срок службы указан производителем: правильно произведенный ондулин эксплуатируется до 25 лет, гарантийный срок составляет 15 лет, но не меньше;
- Выбор типа материала зависит и от формы вашей кровли: для простой можно использовать волнообразный, для сложной – черепицу.

Как вы уже могли убедиться, делают ондулин только из натуральных, безопасных материалов, основным компонентом является переработанная и очищенная целлюлоза. Кроме того, листы пропитываются битумом, который придает прочность покрытию, водонепроницаемость и прочие положительные свойства. Но вы не должны забывать и о том, что любой строительный материал имеет и свои недостатки, которые могут проявляться в самых неожиданных условиях. Поэтому, несмотря на всю экологичность и простоту укладки ондулина, при его выборе тщательно взвесьте все «за» и «против», после этого правильно выбирайте материал, не забудьте про комплектующие, доборные элементы.
Клеточные фабрики по производству инсулина
1. Cohen SN, Chang ACY, Boyer HW, Helling RB. Конструирование биологически функциональных бактериальных плазмид in vitro. Proc Natl Acad Sci U S A. 1973; 70:3240–3244. doi: 10.1073/pnas.70.11.3240. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
2. Нильсен Дж. Производство биофармацевтических белков дрожжами. Landes Biosci Bioengineered. 2013;4(4):207–211. doi: 10.4161/bioe.22856. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Производство биофармацевтических белков дрожжами. Landes Biosci Bioengineered. 2013;4(4):207–211. doi: 10.4161/bioe.22856. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Гудман М., Обзор рынка Продажи биопрепаратов продемонстрируют устойчивый рост до 2013 года. Nat Rev Drug Discov. 2009; 8:837. doi: 10.1038/nrd3040. [PubMed] [CrossRef] [Google Scholar]
4. Аггарвал С. Что подпитывает биотехнологический двигатель с 2010 по 2011 год. Nat Biotechnol. 2011;29:1083–1089. doi: 10.1038/nbt.2060. [PubMed] [CrossRef] [Google Scholar]
5. Walsh G. Biopharmaceuticals: одобрения и тенденции одобрения в 2004 г. Biopharm Int. 2005; 18:58–65. [Google Scholar]
6. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2005 г. BioPharm Int. 2006;9: 58–68. [Google Scholar]
7. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2006 г. BioPharm Int. 2007; 20:40–48. [Google Scholar]
8. Walsh G. Biopharmaceuticals: тенденции одобрения в 2007 г. BioPharm Int. 2008; 21:52–65. [Google Scholar]
BioPharm Int. 2008; 21:52–65. [Google Scholar]
9. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2008 г. BioPharm Int. 2009;22(10):68–77. [Google Scholar]
10. Уолш Г. Тенденции одобрения биофармацевтических препаратов в 2009 г. BioPharm Int. 2010;23(10):30–41. [Академия Google]
11. Уолш Г. Биофармацевтические эталоны. Нац биотехнолог. 2010;28:917–924. doi: 10.1038/nbt0910-917. [PubMed] [CrossRef] [Google Scholar]
12. Уолш Г. Новые биофармацевтические препараты. БиоФарм Инт. 2012; 25:34–36. [Google Scholar]
13. Уолш Г. Тенденции одобрения биофармацевтических препаратов в 2013 году. Biopharm Int. 2013;26(4):54–56. [Google Scholar]
14. Уолш Г. Терапевтические инсулины и их крупномасштабное производство. Приложение Microbiol Biotechnol. 2005; 67: 151–159. doi: 10.1007/s00253-004-1809-Икс. [PubMed] [CrossRef] [Google Scholar]
15. Ferrer-Miralles N, Domingo-Espin J, Corchero JL, Vazquez E, Villaverde A. Микробные фабрики для рекомбинантных фармацевтических препаратов. Факт микробной клетки. 2009; 8:17. дои: 10.1186/1475-2859-8-17. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Факт микробной клетки. 2009; 8:17. дои: 10.1186/1475-2859-8-17. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Nilsson J, Jonasson P, Samuelsson E, Stahl S, Uhlen M. Интегрированное производство человеческого инсулина и его С-пептида. Дж Биотехнолог. 1996; 48: 241–250. doi: 10.1016/0168-1656(96)01514-3. [PubMed] [CrossRef] [Академия Google]
17. Thim L, Hansen MT, Norris K, Hoegh I, Boel E, Forstrom J, Ammerer G, Fiil NP. Секреция и процессинг предшественников инсулина в дрожжах. Proc Natl Acad Sci U S A. 1986; 83:6766–6770. doi: 10.1073/pnas.83.18.6766. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Markussen J, Damgaard U, Diers I, Fiil N, Hansen MT, Larsen P, Norris F, Norris K, Schou O, Snel L, Thim Л, Фойгт ХО. Биосинтез человеческого инсулина в дрожжах через одноцепочечные предшественники. Диабетология. 1986;29:568А–569А. [Google Scholar]
19. Kjeldsen T. Секреторная экспрессия предшественников инсулина в дрожжах. Приложение Microbiol Biotechnol. 2000; 54: 277–286. doi: 10.1007/s002530000402. [PubMed] [CrossRef] [Google Scholar]
2000; 54: 277–286. doi: 10.1007/s002530000402. [PubMed] [CrossRef] [Google Scholar]
20. Холленберг С.П., Геллиссен Г. Производство рекомбинантных белков метилотрофными дрожжами. Курр Опин Биотехнолог. 1997; 8: 554–560. doi: 10.1016/S0958-1669(97)80028-6. [PubMed] [CrossRef] [Google Scholar]
21. Геллиссен Г., Холленберг С.П. Применение дрожжей в исследованиях экспрессии генов Сравнение Saccharomyces cerevisiae, Hansenula polymorpha и Kluyveromyces lactis – обзор. Ген. 1997;190:87–97. doi: 10.1016/S0378-1119(97)00020-6. [PubMed] [CrossRef] [Google Scholar]
22. Романос М. Достижения в использовании Pichia pastoris для экспрессии генов высокого уровня. Курр Опин Биотехнолог. 1995; 6: 527–533. doi: 10.1016/0958-1669(95)80087-5. [CrossRef] [Google Scholar]
23. Weydemann U, Keup P, Piontek M, Strasser AW, Schweden J, Gellissen G, Janowicz ZA. Высокий уровень секреции гирудина Hansenula polymorpha — аутентичный процессинг трех разных препрогирудинов. Приложение Microbiol Biotechnol. 1995;44:377–385. doi: 10.1007/BF00169932. [PubMed] [CrossRef] [Google Scholar]
1995;44:377–385. doi: 10.1007/BF00169932. [PubMed] [CrossRef] [Google Scholar]
24. Порро Д., Зауэр М., Брандуарди П., Маттанович Д. Производство рекомбинантного белка в дрожжах. Мол Биотехнолог. 2005; 31: 245–259. doi: 10.1385/МБ:31:3:245. [PubMed] [CrossRef] [Google Scholar]
25. Yanagita M, Nakayama K, Takeuchi T. Процессинг мутантного проинсулина с сайтами четырехосновного расщепления в биоактивный инсулин в неэндокринной клеточной линии COS-7. ФЭБС лат. 1992; 311: 55–59. дои: 10.1016/0014-5793(92)81366-Т. [PubMed] [CrossRef] [Google Scholar]
26. Arakawa T, Yu J, Chong DKX, Hough J, Engen PC, Langridge WHR. Слитый белок субъединицы холерного токсина В и инсулина растительного происхождения защищает от развития аутоиммунного диабета. Нац биотехнолог. 1998; 16: 934–938. doi: 10.1038/nbt1098-934. [PubMed] [CrossRef] [Google Scholar]
27. Nykiforuk CL, Boothe JG, Murray EW, Keon RG, Goren HJ, Markley NA, Moloney MM. Трансгенная экспрессия и выделение биологически активного рекомбинантного инсулина человека из семян Arabidopsis thaliana. Plant Biotech J. 2006; 4:77–85. doi: 10.1111/j.1467-7652.2005.00159.Икс. [PubMed] [CrossRef] [Google Scholar]
Plant Biotech J. 2006; 4:77–85. doi: 10.1111/j.1467-7652.2005.00159.Икс. [PubMed] [CrossRef] [Google Scholar]
28. Boyhan D, Daniel H. Недорогое производство проинсулина в хлоропластах табака и салата для инъекций или пероральной доставки функционального инсулина и C-пептида. Plant Biotech J. 2011;9:585–598. doi: 10.1111/j.1467-7652.2010.00582.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Wild S, Roglic G, Green A, Sicree R, King H. Глобальная распространенность диабета: оценки на 2000 год и прогнозы на 2030 год. Диабет Уход. 2004; 27:1047–1053. doi: 10.2337/diacare.27.5.1047. [PubMed] [CrossRef] [Академия Google]
30. Сахдев С., Хаттар С.К., Сайни К.С. Производство активных эукариотических белков с помощью бактериальных систем экспрессии: обзор существующих биотехнологических стратегий. Мол Селл Биохим. 2008; 307: 249–264. doi: 10.1007/s11010-007-9603-6. [PubMed] [CrossRef] [Google Scholar]
31. Арья Р., Бхаттачарья А., Шайни К.С. Dictyostelium discoideum — многообещающая система экспрессии для продукции эукариотических белков. FASEB J. 2008; 22:4055–4066. doi: 10.1096/fj.08-110544. [PubMed] [CrossRef] [Академия Google]
Dictyostelium discoideum — многообещающая система экспрессии для продукции эукариотических белков. FASEB J. 2008; 22:4055–4066. doi: 10.1096/fj.08-110544. [PubMed] [CrossRef] [Академия Google]
32. Ferrer-Miralles N, Villaverde A. Фабрики бактериальных клеток для производства рекомбинантных белков; расширение каталога. Факт микробной клетки. 2013;12:113. дои: 10.1186/1475-2859-12-113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Kjeldsen T, Pettersson AF, Hach M. Секреторная экспрессия и характеристика инсулина у Pichia pastoris. Биотехнология Appl Biochem. 1999; 29: 79–86. [PubMed] [Google Scholar]
34. Gerngross TU. Достижения в производстве терапевтических белков человека в дрожжах и мицелиальных грибах. Нац биотехнолог. 2004;22:1409–1414. doi: 10.1038/nbt1028. [PubMed] [CrossRef] [Google Scholar]
35. Мансур М., Кабельо С., Эрнандес Л., Паис Дж., Варас Л., Вальдес Дж., Терреро Й., Идальго А., Плана Л., Бесада В., Гарсия Л., Ламазарес Э. , Кастелланос Л., Мартинес Э. Множественное количество копий гена усиливает секрецию предшественника инсулина у дрожжей Pichia pastoris. Биотехнологическая лат. 2005; 27: 339–345. doi: 10.1007/s10529-005-1007-7. [PubMed] [CrossRef] [Google Scholar]
, Кастелланос Л., Мартинес Э. Множественное количество копий гена усиливает секрецию предшественника инсулина у дрожжей Pichia pastoris. Биотехнологическая лат. 2005; 27: 339–345. doi: 10.1007/s10529-005-1007-7. [PubMed] [CrossRef] [Google Scholar]
36. Wurm FM. Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. Нац биотехнолог. 2004; 22:1358–139.3. doi: 10.1038/nbt1026. [PubMed] [CrossRef] [Google Scholar]
37. Vajo Z, Fawcett J, Duckworth WC. Технология рекомбинантной ДНК в лечении диабета: аналоги инсулина. Endocr Rev. 2001; 22:706–717. doi: 10.1210/edrv.22.5.0442. [PubMed] [CrossRef] [Google Scholar]
38. Ахмад Б. Фармакология инсулина. Br J Диабет Vasc Dis. 2004; 4:10–14. doi: 10.1177/14746514040040010201. [CrossRef] [Google Scholar]
39. Дженкинс Н. Модификации терапевтических белков: проблемы и перспективы. Цитотехнология. 2007; 53: 121–125. doi: 10.1007/s10616-007-9075-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Уолш Г., Джефферис Р. Посттрансляционные модификации в контексте терапевтических белков. Нац биотехнолог. 2006; 24:1241–1252. doi: 10.1038/nbt1252. [PubMed] [CrossRef] [Google Scholar]
Уолш Г., Джефферис Р. Посттрансляционные модификации в контексте терапевтических белков. Нац биотехнолог. 2006; 24:1241–1252. doi: 10.1038/nbt1252. [PubMed] [CrossRef] [Google Scholar]
41. Wacker M, Linton D, Hitchen PG, Nita-Lazar M, Haslam SM, North SJ, Panico M, Morris HR, Dell A, Wren BW, Aebi M. N -связанное гликозилирование в Campylobacter jejuni и его функциональный перенос в E. coli. Наука. 2002;298: 1790–1793. doi: 10.1126/science.298.5599.1790. [PubMed] [CrossRef] [Google Scholar]
42. Feldman MF, Wacker M, Hernandez M, Hitchen PG, Marolda CL, Kowarik M, Morris HR, Dell A, Valvano MA, Aebi M. Engineering N-связанное гликозилирование белков с разнообразными структурами липополисахарида О-антигена в Escherichia coli. Proc Natl Acad Sci U S A. 2005;102:3016–3021. doi: 10.1073/pnas.0500044102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Wacker M, Feldman MF, Callewaert N, Kowarik M, Clarke BR, Pohl NL, Hernandez M, Vines ED, Valvano MA, Whitfield C, Aebi М. Субстратная специфичность бактериальной олигосахарилтрансферазы предполагает общий механизм переноса для бактериальной и эукариотической систем. Proc Natl Acad Sci U S A. 2006; 103:7088–709.3. doi: 10.1073/pnas.0509207103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Субстратная специфичность бактериальной олигосахарилтрансферазы предполагает общий механизм переноса для бактериальной и эукариотической систем. Proc Natl Acad Sci U S A. 2006; 103:7088–709.3. doi: 10.1073/pnas.0509207103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Fisher AC, Haitjema CH, Guarino C, Celik E, Endicott CE, Reading CA, Merritt JH, Ptak AC, Zhang S, DeLisa MP. Продукция секреторных и внеклеточных N-связанных гликопротеинов в Escherichia coli. Appl Environ Microbiol. 2011;77:871–881. doi: 10.1128/AEM.01901-10. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
45. Ihssen J, Kowarik M, Dilettoso S, Tanner C, Wacker M, Thoxy-Meyer L. Производство гликопротеиновых вакцин в Escherichia coli. Факт микробной клетки. 2010;9:61. дои: 10.1186/1475-2859-9-61. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
46. Lizak C, Fan Y, Web TC, Aebi M. N-связанное гликозилирование фрагментов антител в Escherichia coli. Биоконьюг Хим. 2011; 22: 488–496. doi: 10.1021/bc100511k. [PubMed] [CrossRef] [Google Scholar]
2011; 22: 488–496. doi: 10.1021/bc100511k. [PubMed] [CrossRef] [Google Scholar]
47. Pandhal H, Ow SY, Noirel J, Wright PC. Улучшение эффективности N-гликозилирования в Escherichia coli с использованием анализа метаболической сети протеомики дробовика и селективного мониторинга реакций. Биотехнология Биоинж. 2011;108:902–912. doi: 10.1002/bit.23011. [PubMed] [CrossRef] [Google Scholar]
48. Чен Р. Бактериальные экспрессионные системы для производства рекомбинантных белков: E. coli и другие. Биотехнология Adv. 2012;30:1102–1107. doi: 10.1016/j.biotechadv.2011.09.013. [PubMed] [CrossRef] [Google Scholar]
49. Makrides SC. Стратегии достижения высокого уровня экспрессии генов в Escherichia coli. Microbiol Rev. 1996;60:512–538. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Kane JF. Влияние кластеров редких кодонов на высокий уровень экспрессии гетерологичных белков в Escherichia coli. Курр Опин Биотехнолог. 1995;6(5):494–500. doi: 10.1016/0958-1669(95)80082-4. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
51. Trundova M, Celer V. Экспрессия гена ORF2 свиного цирковируса 2 нуждается в кодон-оптимизированных клетках E.coli. Гены вирусов. 2007; 34: 199–204. doi: 10.1007/s11262-006-0043-2. [PubMed] [CrossRef] [Google Scholar]
52. Sorensen HP, Sperling-Petersen HU, Mortensen KK. Производство рекомбинантных термостабильных белков, экспрессированных в Escherichia coli: завершение синтеза белка является узким местом. J Chromatogr B Analyt Technol Biomed Life Sci. 2003; 786: 207–214. дои: 10.1016/S1570-0232(02)00689-ИКС. [PubMed] [CrossRef] [Google Scholar]
53. Bill RM, Henderson PJF, Iwata S, Kunji ERS, Michel H, Neutze R, Newstead S, Poolman B, Tate CG, Voge H. Преодоление барьеров в структуре мембранного белка определение. Нац биотехнолог. 2011;29(4):335–340. doi: 10.1038/nbt.1833. [PubMed] [CrossRef] [Google Scholar]
54. Huang CJ, Lin H, Yang X. Промышленное производство рекомбинантных терапевтических средств в Escherichia coli и его последние достижения. J Ind Microbiol Biotechnol. 2012; 39: 383–39.9. doi: 10.1007/s10295-011-1082-9. [PubMed] [CrossRef] [Google Scholar]
J Ind Microbiol Biotechnol. 2012; 39: 383–39.9. doi: 10.1007/s10295-011-1082-9. [PubMed] [CrossRef] [Google Scholar]
55. Рейли Д.Э., Янсура Д.Г. Продукция моноклональных антител в E. coli. В: Шайр С.Дж., Гомботц В., Бехтольд-Питерс К., Андья Дж., редакторы. Современные тенденции в разработке и производстве моноклональных антител. Нью-Йорк: Спрингер; 2010. С. 295–308. [Google Scholar]
56. Овертон Т.В. Продукция рекомбинантных белков в бактериях-хозяевах. Наркотиков Дисков сегодня. 2014;19(5):590–601. doi: 10.1016/j.drudis.2013.11.008. [PubMed] [CrossRef] [Академия Google]
57. Каррио М.М., Вильяверде А. Роль молекулярных шаперонов в формировании телец включения. Фебс Летт. 2003;537(1–3):215–221. doi: 10.1016/S0014-5793(03)00126-1. [PubMed] [CrossRef] [Google Scholar]
58. Де Марко А. Протокол получения белков с улучшенной растворимостью путем совместной экспрессии с молекулярными шаперонами в Escherichia coli. Нат Проток. 2007;2(10):2632–2639. doi: 10.1038/nprot.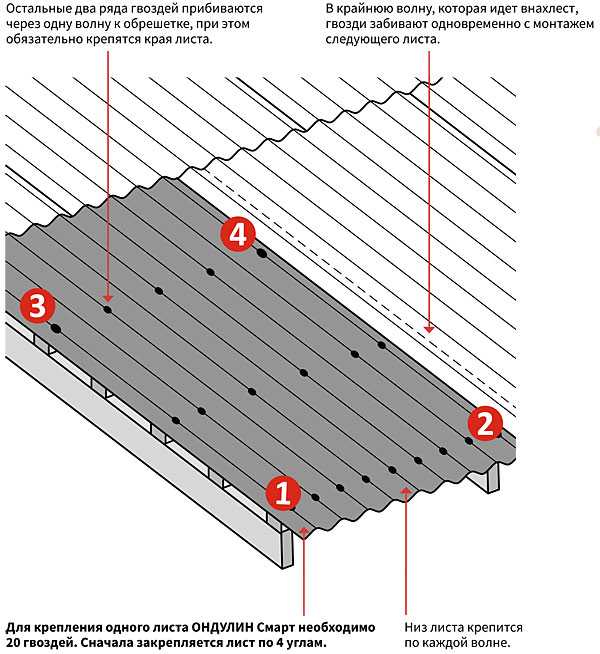 2007.400. [PubMed] [CrossRef] [Google Scholar]
2007.400. [PubMed] [CrossRef] [Google Scholar]
59. Chance R, Frank B. Исследование, разработка, производство и безопасность биосинтетического человеческого инсулина. Уход за диабетом. 1993;16(3):133–142. [PubMed] [Google Scholar]
60. Chance R, Glazer N, Wishner K. Insulin Lispro (Humalog) In: Walsh G, Murphy B, editors. Биофармацевтика, промышленная перспектива. Клювер: Дордрехт; 1999. С. 149–172. [Google Scholar]
61. Бланделл Т., Додсон Г., Ходжкин Д., Меркола Д. Инсулин: структура в кристалле и ее отражение в химии и биологии. Adv Prot Chem. 1972; 26: 279–402. doi: 10.1016/S0065-3233(08)60143-6. [CrossRef] [Google Scholar]
62. Kang S, Creagh F, Peters J, Brange J, Volund A, Owens D. Сравнение подкожного растворимого человеческого инсулина и аналогов инсулина на колебания уровня глюкозы в плазме, связанные с приемом пищи, у больных диабетом 1-го типа. предметы. Уход за диабетом. 1991;14:571–577. doi: 10.2337/diacare.14.7.571. [PubMed] [CrossRef] [Google Scholar]
63. Брандж Дж., Рибель Дж., Хансен Дж.Ф., Додсон Г., Хансен М.Т., Хавелунд С., Мельберг С.Г., Норрис К., Норрис Л., Снел Л., Соренсен А.Р., Фойгт Х.О. Мономерные инсулины, полученные с помощью белковой инженерии, и их медицинские последствия. Природа. 1988; 333: 679–682. doi: 10.1038/333679a0. [PubMed] [CrossRef] [Google Scholar]
Брандж Дж., Рибель Дж., Хансен Дж.Ф., Додсон Г., Хансен М.Т., Хавелунд С., Мельберг С.Г., Норрис К., Норрис Л., Снел Л., Соренсен А.Р., Фойгт Х.О. Мономерные инсулины, полученные с помощью белковой инженерии, и их медицинские последствия. Природа. 1988; 333: 679–682. doi: 10.1038/333679a0. [PubMed] [CrossRef] [Google Scholar]
64. Brange J, Owens DR, Kang S, Volund A. Мономерные инсулины и их экспериментальное и клиническое значение. Уход за диабетом. 1990;13(9):923–954. doi: 10.2337/diacare.13.9.923. [PubMed] [CrossRef] [Google Scholar]
65. Wildt S, Gerngross TU. Гуманизация путей N-гликозилирования у дрожжей. Нат микробиол. 2005;3:119–128. doi: 10.1038/nrmicro1087. [PubMed] [CrossRef] [Google Scholar]
66. Гринна Л.С., Чопп Дж.Ф. Распределение по размерам и общие структурные особенности N-связанных олигосахаридов метилотрофных дрожжей Pichia pastoris. Дрожжи. 1989; 5: 107–115. doi: 10.1002/yea.320050206. [PubMed] [CrossRef] [Академия Google]
67. Tschopp JF, Sverlow G, Kosson R, Craig W, Grinna L. Высокий уровень секреции гликозилированной инвертазы у метилотрофных дрожжей pichia pastoris. Биотехнология. 1987; 5: 1305–1308. doi: 10.1038/nbt1287-1305. [CrossRef] [Google Scholar]
Высокий уровень секреции гликозилированной инвертазы у метилотрофных дрожжей pichia pastoris. Биотехнология. 1987; 5: 1305–1308. doi: 10.1038/nbt1287-1305. [CrossRef] [Google Scholar]
68. Ellis SB, Brust PF, Koutz PJ, Waters AF, Harpold MM, Gingeras TR. Выделение алкогольоксидазы и двух других генов, регулируемых метанолом, из дрожжей Pichia pastoris. Мол Селл Биол. 1985; 5: 1111–1121. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Tschopp JF, Brust PF, Cregg JM, Stillman C, Gingeras TR. Экспрессия гена lacZ из двух промоторов, регулируемых метанолом, у Pichia pastoris. Нуклеиновые Кислоты Res. 1987; 15: 3859–3876. doi: 10.1093/нар/15.9.3859. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Порро Д., Гассер Б., Фоссати Т., Маурер М., Брандуарди П., Зауэр М., Маттанович Д. Производство рекомбинантных белков и метаболитов в дрожжах. Приложение Microbiol Biotechnol. 2011; 89: 939–948. doi: 10.1007/s00253-010-3019-з. [PubMed] [CrossRef] [Google Scholar]
71. Shin CS, Hong MS, Bae CS, Lee J. Повышенное производство мини-проинсулина человека в культурах с подпиткой при высокой плотности клеток Escherichia coli BL21 (DE3) [ pET-3aT2M2] Biotechnol Prog. 1997; 13: 249–257. doi: 10.1021/bp970018m. [PubMed] [CrossRef] [Google Scholar]
Shin CS, Hong MS, Bae CS, Lee J. Повышенное производство мини-проинсулина человека в культурах с подпиткой при высокой плотности клеток Escherichia coli BL21 (DE3) [ pET-3aT2M2] Biotechnol Prog. 1997; 13: 249–257. doi: 10.1021/bp970018m. [PubMed] [CrossRef] [Google Scholar]
72. Mergulhao F, Taipa M, Cabral J, Monteiro G. Оценка узких мест в секреции проинсулина Escherichia coli. Дж Биотехнолог. 2004; 109:31–43. doi: 10.1016/j.jbiotec.2003.10.024. [PubMed] [CrossRef] [Академия Google]
73. Гуррамконда С., Полез С., Скоко Н., Аднан А., Гэйбл Т., Чу Д., Сваминатан С., Ханна Н., Тисминецки С., Ринас У. Применение простого метода периодической подпитки для секреторного производства предшественника инсулина на высоком уровне. с использованием Pichia pastoris с последующей очисткой и конверсией в человеческий инсулин. Факт микробной клетки. 2010;9:31. дои: 10.1186/1475-2859-9-31. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Owens DR, Vora JP, Dolben J. Человеческий инсулин и не только: обзор технологии полусинтеза и рекомбинантной ДНК. В: Pickup JC, редактор. Биотехнология инсулинотерапии. Оксфорд: Блэквелл; 1991. стр. 24–41. [Google Scholar]
Человеческий инсулин и не только: обзор технологии полусинтеза и рекомбинантной ДНК. В: Pickup JC, редактор. Биотехнология инсулинотерапии. Оксфорд: Блэквелл; 1991. стр. 24–41. [Google Scholar]
75. Фрэнк Б. Манипулирование положением пролина в В-цепи привело к получению мономерных инсулинов. Сахарный диабет. 1991; 40 (Приложение 1): 423A. [Google Scholar]
76. Kurtzhals P, Havelund S, Jonassen S, Markussen J. Влияние жирных кислот и некоторых лекарств на связывание альбумина ацилированного аналога инсулина длительного действия. Дж. Фарм. 1997;86(12):1365–1368. doi: 10.1021/js9701768. [PubMed] [CrossRef] [Google Scholar]
77. Owens DR, Zinman B, Bolli G. Инсулины сегодня и в будущем. Ланцет. 2001;358:739–746. doi: 10.1016/S0140-6736(01)05842-1. [PubMed] [CrossRef] [Google Scholar]
78. Havelund S, Plum A, Ribel U, Jonassen I, Volund A, Markussen J, Kurtzhals P. Механизм пролонгации инсулина детемира, ацилированного аналога длительного действия. человеческого инсулина. Фарм Рез. 2004;21(8):1498–1504. doi: 10.1023/B:PHAM.0000036926.54824.37. [PubMed] [CrossRef] [Google Scholar]
Фарм Рез. 2004;21(8):1498–1504. doi: 10.1023/B:PHAM.0000036926.54824.37. [PubMed] [CrossRef] [Google Scholar]
79. Hou J, Tyo KEJ, Liu Z, Petranovic D, Nielsen J. Метаболическая инженерия секреции рекомбинантных белков Saccharomyces cerevisiae. FEMS Yeast Res. 2012;12:491–510. doi: 10.1111/j.1567-1364.2012.00810.x. [PubMed] [CrossRef] [Google Scholar]
80. Kjeldsen T, Hach M, Balschmidt P, Havelund S, Pettersson AF, Markussen J. Препролидеры, лишенные N-связанного гликозилирования для секреторной экспрессии в дрожжах Saccharomyces cerevisiae. Protein Expr Purif. 1998; 14: 309–316. doi: 10.1006/преп.1998.0977. [PubMed] [CrossRef] [Google Scholar]
81. Staub JM, Garcia B, Graves J, Hajdukiewicz PT, Hunter P, Nehra N, Paradkar V, Schlittler M, Carroll JA, Spatola L, Ward D, Ye G, Рассел Д.А. Высокопродуктивная продукция терапевтического белка человека в хлоропластах табака. Нац биотехнолог. 2000;18:333–338. дои: 10.1038/73796. [PubMed] [CrossRef] [Google Scholar]
82. Van Rooijen GJH, Moloney MM. Масличные тельца семян растений как носители чужеродных белков. Биотехнология. 1995; 13:72–77. doi: 10.1038/nbt0195-72. [PubMed] [CrossRef] [Google Scholar]
Van Rooijen GJH, Moloney MM. Масличные тельца семян растений как носители чужеродных белков. Биотехнология. 1995; 13:72–77. doi: 10.1038/nbt0195-72. [PubMed] [CrossRef] [Google Scholar]
83. Deckers H, Moloney MM, Baum A. Случай рекомбинантного производства фармацевтических белков в растениях. Annu Rep Med Chem. 1999; 34: 237–245. doi: 10.1016/S0065-7743(08)60586-2. [CrossRef] [Google Scholar]
Инсулин | Определение, структура и функции
Инсулин
, открытие
Посмотреть все СМИ
- Ключевые люди:
- Николас К. Паулеску
Сэр Фредерик Грант Бантинг
Чарльз Х. Бест
Фредерик Сэнгер
Дэвидсон Никол
- Похожие темы:
- поджелудочная железа
островки Лангерганса
гликогенез
бета-клетка
гормон поджелудочной железы
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
инсулин , гормон, который регулирует уровень сахара (глюкозы) в крови и вырабатывается бета-клетками островков Лангерганса в поджелудочной железе. Инсулин секретируется, когда уровень глюкозы в крови повышается, например, после еды. Когда уровень глюкозы в крови падает, секреция инсулина прекращается, и печень выбрасывает глюкозу в кровь. Впервые инсулин был обнаружен в экстрактах поджелудочной железы в 1921, идентифицированный канадскими учеными Фредериком Г. Бантингом и Чарльзом Х. Бестом, а также румынским физиологом Николасом К. Паулеску, который работал независимо и назвал это вещество «панкреином». После того, как Бантинг и Бест выделили инсулин, они начали работу по получению очищенного экстракта, которую они выполнили с помощью шотландского физиолога Дж. Дж. Р. Маклауд и канадский химик Джеймс Б. Коллип. Бантинг и Маклауд разделили Нобелевскую премию по физиологии и медицине 1923 года за свою работу.
Инсулин секретируется, когда уровень глюкозы в крови повышается, например, после еды. Когда уровень глюкозы в крови падает, секреция инсулина прекращается, и печень выбрасывает глюкозу в кровь. Впервые инсулин был обнаружен в экстрактах поджелудочной железы в 1921, идентифицированный канадскими учеными Фредериком Г. Бантингом и Чарльзом Х. Бестом, а также румынским физиологом Николасом К. Паулеску, который работал независимо и назвал это вещество «панкреином». После того, как Бантинг и Бест выделили инсулин, они начали работу по получению очищенного экстракта, которую они выполнили с помощью шотландского физиолога Дж. Дж. Р. Маклауд и канадский химик Джеймс Б. Коллип. Бантинг и Маклауд разделили Нобелевскую премию по физиологии и медицине 1923 года за свою работу.
Инсулин представляет собой белок, состоящий из двух цепей: цепи А (с 21 аминокислотой) и цепи В (с 30 аминокислотами), которые связаны друг с другом атомами серы. Инсулин получают из молекулы прогормона, состоящей из 74 аминокислот, называемой проинсулином. Проинсулин относительно неактивен, и в нормальных условиях секретируется лишь небольшое его количество. В эндоплазматическом ретикулуме бета-клеток молекула проинсулина расщепляется в двух местах, образуя цепи А и В инсулина и промежуточный биологически неактивный пептид С. Цепи А и В соединяются вместе двумя серо-серными (дисульфидными) связями. Проинсулин, инсулин и пептид С хранятся в гранулах в бета-клетках, из которых они высвобождаются в капилляры островков в ответ на соответствующие стимулы. Эти капилляры впадают в воротную вену, которая несет кровь от желудка, кишечника и поджелудочной железы к печени. Поджелудочная железа нормального взрослого человека содержит примерно 200 единиц инсулина, а среднесуточная секреция инсулина в кровоток у здоровых людей колеблется от 30 до 50 единиц.
Проинсулин относительно неактивен, и в нормальных условиях секретируется лишь небольшое его количество. В эндоплазматическом ретикулуме бета-клеток молекула проинсулина расщепляется в двух местах, образуя цепи А и В инсулина и промежуточный биологически неактивный пептид С. Цепи А и В соединяются вместе двумя серо-серными (дисульфидными) связями. Проинсулин, инсулин и пептид С хранятся в гранулах в бета-клетках, из которых они высвобождаются в капилляры островков в ответ на соответствующие стимулы. Эти капилляры впадают в воротную вену, которая несет кровь от желудка, кишечника и поджелудочной железы к печени. Поджелудочная железа нормального взрослого человека содержит примерно 200 единиц инсулина, а среднесуточная секреция инсулина в кровоток у здоровых людей колеблется от 30 до 50 единиц.
Несколько факторов стимулируют секрецию инсулина, но наиболее важным из них является концентрация глюкозы в артериальной (насыщенной кислородом) крови, перфузирующей островки. Когда концентрация глюкозы в крови увеличивается (например, после еды), большое количество глюкозы поглощается и метаболизируется бета-клетками, а секреция инсулина увеличивается. И наоборот, по мере снижения концентрации глюкозы в крови снижается секреция инсулина; однако даже во время голодания выделяется небольшое количество инсулина. Секреция инсулина также может стимулироваться некоторыми аминокислотами, жирными кислотами, кетокислотами (продуктами окисления жирных кислот) и некоторыми гормонами, секретируемыми желудочно-кишечным трактом. Секреция инсулина ингибируется соматостатином и активацией симпатической нервной системы (ветви вегетативной нервной системы, ответственной за реакцию «бей или беги»).
И наоборот, по мере снижения концентрации глюкозы в крови снижается секреция инсулина; однако даже во время голодания выделяется небольшое количество инсулина. Секреция инсулина также может стимулироваться некоторыми аминокислотами, жирными кислотами, кетокислотами (продуктами окисления жирных кислот) и некоторыми гормонами, секретируемыми желудочно-кишечным трактом. Секреция инсулина ингибируется соматостатином и активацией симпатической нервной системы (ветви вегетативной нервной системы, ответственной за реакцию «бей или беги»).
Инсулин в первую очередь стимулирует поглощение глюкозы тремя тканями — жировой (жировой), мышцей и печенью, которые играют важную роль в метаболизме и хранении питательных веществ. Как и другие белковые гормоны, инсулин связывается со специфическими рецепторами на внешней мембране своих клеток-мишеней, тем самым активируя метаболические процессы внутри клеток. Ключевое действие инсулина в этих клетках заключается в стимуляции переноса переносчиков глюкозы (молекул, которые опосредуют поглощение клетками глюкозы) изнутри клетки к клеточной мембране.
В жировой ткани инсулин стимулирует поглощение и утилизацию глюкозы. Присутствие глюкозы в жировых клетках, в свою очередь, приводит к повышенному поглощению жирных кислот из кровотока, увеличению синтеза жирных кислот в клетках и усилению этерификации (когда молекула кислоты связывается со спиртом) жирных кислот глицерином с образованием триглицеридов. , форма хранения жира. Кроме того, инсулин является мощным ингибитором распада триглицеридов (липолиза). Это предотвращает высвобождение жирных кислот и глицерина из жировых клеток, сохраняя их до тех пор, пока они не понадобятся организму (например, во время тренировки или голодания). По мере снижения концентрации инсулина в сыворотке увеличивается липолиз и высвобождение жирных кислот.
В мышечной ткани инсулин стимулирует транспорт глюкозы и аминокислот в мышечные клетки. Глюкоза хранится в виде гликогена, запасной молекулы, которая может быть расщеплена для получения энергии для сокращения мышц во время упражнений и для обеспечения энергией во время голодания. Аминокислоты, транспортируемые в мышечные клетки в ответ на стимуляцию инсулином, используются для синтеза белка. Напротив, в отсутствие инсулина белок мышечных клеток расщепляется, чтобы поставлять аминокислоты в печень для превращения в глюкозу.
Аминокислоты, транспортируемые в мышечные клетки в ответ на стимуляцию инсулином, используются для синтеза белка. Напротив, в отсутствие инсулина белок мышечных клеток расщепляется, чтобы поставлять аминокислоты в печень для превращения в глюкозу.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Инсулин не требуется для транспорта глюкозы в клетки печени, но он оказывает сильное влияние на метаболизм глюкозы в этих клетках. Стимулирует образование гликогена, ингибирует распад гликогена (гликогенолиз) и синтез глюкозы из аминокислот и глицерина (глюконеогенез). Таким образом, общий эффект инсулина заключается в увеличении накопления глюкозы и снижении продукции и высвобождения глюкозы печенью. Этому действию инсулина противостоит глюкагон, другой гормон поджелудочной железы, вырабатываемый клетками островков Лангерганса.
Неадекватная выработка инсулина является причиной состояния, называемого сахарным диабетом.




 Любая криволинейная плоскость с радиусом кривизны более 5 м может быть покрыта данным материалом.
Любая криволинейная плоскость с радиусом кривизны более 5 м может быть покрыта данным материалом.



 Если при покупке вы не заметили их сразу, заменить упаковку будет трудно.
Если при покупке вы не заметили их сразу, заменить упаковку будет трудно. Его длина – 100 см, полезная – 85 см.
Его длина – 100 см, полезная – 85 см.